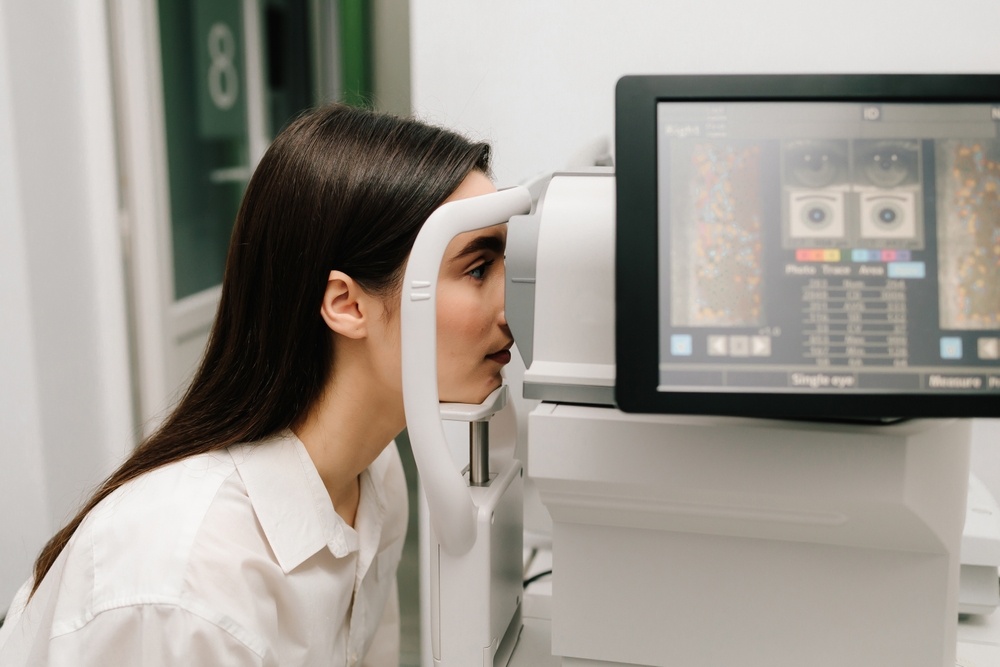
Μια νέα εποχή στη θεραπευτική προσέγγιση για ασθενείς με Φυλοσύνδετη Μελαχρωστική Αμφιβληστροειδοπάθεια (X-linked Retinitis Pigmentosa – XLRP) ανατέλλει, σύμφωνα με τα αποτελέσματα της πολυκεντρικής ερευνητικής μελέτης LUMEOS, που ολοκληρώθηκε με επιτυχία στις Ηνωμένες Πολιτείες. Η μελέτη, που επικεντρώνεται στη γονιδιακή θεραπεία με το μόριο bota-vec, κατέγραψε εντυπωσιακά αποτελέσματα, δίνοντας νέα ελπίδα σε ασθενείς με κληρονομικές εκφυλιστικές παθήσεις του αμφιβληστροειδούς.
Η Retina International – η Διεθνής Οργάνωση για τις Παθήσεις του Αμφιβληστροειδούς – με ανακοίνωσή της στις 9 Ιουνίου 2025, ενημέρωσε την παγκόσμια κοινότητα για την ολοκλήρωση της Φάσης 3 της μελέτης. Στο εγχείρημα συμμετείχε ενεργά το Ίδρυμα Ενάντια στην Τυφλότητα (Foundation Fighting Blindness – FFB), ενώ την ανάπτυξη και υλοποίηση της θεραπείας ανέλαβε η φαρμακευτική εταιρεία Johnson & Johnson, σε συνεργασία με επιστημονικούς φορείς και ακαδημαϊκά ιδρύματα.
Η Πανελλήνια Ένωση Αμφιβληστροειδοπαθών (Π.Ε.Α.) χαιρετίζει με ενθουσιασμό τη σημαντική αυτή εξέλιξη, τονίζοντας ότι «πρόκειται για ένα επιστημονικό επίτευγμα που ενδέχεται να αλλάξει ριζικά τη ζωή των πασχόντων από XLRP και να προσφέρει φως – κυριολεκτικά και μεταφορικά – σε μια κοινότητα που επί δεκαετίες στερείται θεραπευτικών επιλογών».
Θετικά κλινικά δεδομένα και προσωπικές μαρτυρίες
Η μελέτη περιλάμβανε ασθενείς με Φυλοσύνδετη Μελαχρωστική Αμφιβληστροειδοπάθεια που έλαβαν γονιδιακή θεραπεία και εμφάνισαν βελτίωση της όρασης, κυρίως υπό συνθήκες χαμηλού φωτισμού.
Σύμφωνα με τα αποτελέσματα:
- 46% των ασθενών (25/55), με Φυλοσύνδετη Μελαχρωστική Αμφιβληστροειδοπάθεια παρουσίασαν βελτίωση τουλάχιστον 10 γραμμάτων στην οπτική οξύτητα χαμηλού φωτισμού (LLVA), έναντι μόλις 7% στην ομάδα ελέγχου (2/30).
- Το 40% των ασθενών εμφάνισε βελτίωση σε δύο ή περισσότερα καταληκτικά σημεία, τη στιγμή που κανένας από την ομάδα ελέγχου δεν παρουσίασε ανάλογη βελτίωση.
- Οι συμμετέχοντες κάνουν λόγο για δραματική αλλαγή στην καθημερινότητά τους. «Ο γιος μας, Μάθιου, υποβλήθηκε σε θεραπεία τον Μάρτιο του 2024. Σήμερα κινείται με ευκολία στο σκοτάδι και δεν χρειάζεται πλέον τη βοήθεια μπαστουνιού», αναφέρει ένας γονέας.
- Άλλος ασθενής περιγράφει: «Είδα αστέρια και σύννεφα τη νύχτα για πρώτη φορά. Ήταν μαγικό».
Επόμενα βήματα: Αίτηση έγκρισης από FDA, EMA και MHRA
Η επιτυχία της LUMEOS ανοίγει τον δρόμο για υποβολή αίτησης έγκρισης (Biologics License Application – BLA) από την Johnson & Johnson προς τις ρυθμιστικές αρχές: τον Οργανισμό Τροφίμων και Φαρμάκων των ΗΠΑ (FDA), τον Ευρωπαϊκό Οργανισμό Φαρμάκων (EMA) και τη Ρυθμιστική Υπηρεσία Φαρμάκων του Ηνωμένου Βασιλείου (MHRA).
Όπως ανέφερε ο Todd Durham, PhD, Αντιπρόεδρος Κλινικών Αποτελεσμάτων στο FFB: «Οι αντικειμενικές μετρήσεις και οι προσωπικές εμπειρίες των ασθενών δείχνουν σαφώς ότι η θεραπεία είναι ασφαλής και αποτελεσματική. Ενδέχεται να φέρει πραγματική διαφορά στη ζωή των πασχόντων».
Έκκληση για πρόσβαση και συνεργασία
Η Π.Ε.Α. απευθύνει έκκληση για στενότερη συνεργασία ανάμεσα στην επιστημονική κοινότητα, τις φαρμακευτικές εταιρείες, τους συλλόγους ασθενών με Αμφιβληστροειδοπάθεια και την Πολιτεία, ώστε η καινοτομία να μετατραπεί σε προσβάσιμη θεραπεία για όλους. Όπως επισημαίνει: «Οι εξελίξεις αυτές πρέπει να γίνουν αφετηρία συλλογικής δράσης για να διασφαλιστεί η ανεμπόδιστη πρόσβαση των πασχόντων στις νέες θεραπείες και η βελτίωση της ποιότητας ζωής τους».
Photo Shutterstock
Διαβάστε επίσης
Διαβητική Αμφιβληστροειδοπάθεια: Η ύπουλη απειλή για την όραση